Contoh Soal Larutan Penyangga Perbandingan Volume – Setelah penambahan 15 ml naoh campuran larutan dalam labu titrasi diencerkan dengan h 2 o murni hingga volume 100 ml. Contoh soal larutan penyangga pilihan ganda dan kunci jawaban beserta pembahasan suatu larutan yang dapat menahan perubahan ph yang besar ketika ion ion hidrogen atau hidroksida ditambahkan atau ketika larutan itu diencerkan disebut larutan buffer penyangga. Ph larutan dalam labu titrasi setelah penambahan 15 ml naoh dan pengenceran. Yang bisa digunakan untuk melengkapi administarsi guru yang dapat di unduh secara gratis dengan menekan tombol download. Jadi yang membentuk larutan penyangga adalah nomor 2 dan 4. Kami menyediakan 60 soal larutan penyangga buffer dan pembahasannya pilihan ganda dari berbagai penerbit buku seperti erlangga..
Jika ph larutan 5 maka konsentrasi h 1 x 10 5.
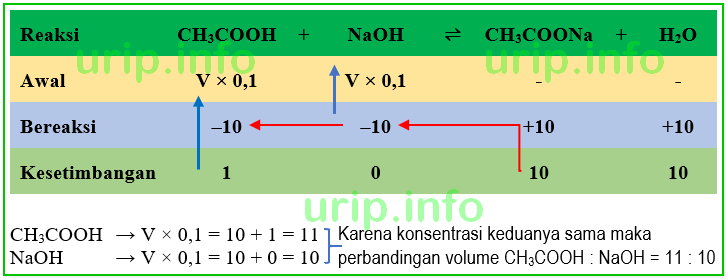
Contoh soal larutan penyangga perbandingan volume. Berapa volume larutan naoh 0 1 m dan ch 3 cooh yang harus ditambahkan untuk membentuk 100 ml larutan penyangga dengan ph 6. 10 contoh soal larutan penyangga buffer. Larutan nh 4 oh dengan volume 200 ml ditambahkan ke dalam 200 ml larutan h 2 so 4 0 05 m sehingga diperoleh larutan penyangga dengan ph 9 2 log 2.
Jika diketahui kb nh 4 oh 10 5 berapa kemolaran larutan nh 4 oh tersebut. Rumus untuk mencari konsentrasi h penyangga asam adalah sebagai berikut. Berikut ini adalah contoh.
Berapa volume larutan naoh 0 1 m dan ch3cooh yang harus ditambahkan untuk membentuk 100 ml larutan penyangga. Soal 2 tentukanlah perbandingan antara volume asam propionat 0 2 m ka 2 x 10 5 dengan natrium propionat 0 1 m untuk menghasilkan larutan penyangga dengan ph 5. Tentukanlah perbandingan antara volume asam propionat 0 2 m ka 2 x 10 5 dengan natrium propionat 0 1 m untuk menghasilkan larutan penyangga dengan ph 5.
Dari beberapa soal yang pernah keluar dalam soal sbmptn bidang study kimia model soal tentang larutan penyangga yang sering keluar antara lain menentukan perbandingan volume dalam larutan penyangga menentukan volume larutan yang harus ditambahkan untuk membuat larutan penyangga dengan ph tertentu mengidentifikasi campuran yang menghasilkan. Ka ch 3 cooh 1 x 10 5. Suatu larutan penyangga dibuat dengan mencampurkan 50 ml larutan ch 3 cooh 0 1 m dengan 25 ml larutan nach 3 coo 0 2 m.
Trik simple untuk menjawab soal seperti ini ialah dengan cara memperhatikan jumlah volume atau molaritas dari kedua senyawa yang dicampurkan semakin jauh perbedaan jumlah volume dan molaritasnya maka semakin besar atau kecil ph yang dihasilkan. Contoh soal perbandingan volume larutan penyangga. H ka x mol al mol garam al asam.
Fenol c 6 h 5 oh merupakan asam lemah dengan k a 10 10 sebanyak 30 ml larutan fenol 0 1 m dititrasi dengan larutan naoh 0 1 m nilai ph dalam labu titrasi dimonitor dengan ph meter. Jika ph larutan 5 maka konsentrasi h 1 x 10 5. Jumlah mol ch 3 cooh 50 ml x 0 1 mmol ml 1.
Tentukan ph larutan penyangga ka ch 3 cooh 1 8 x 10 5 pembahasan. 20 contoh soal dan pembahasanya hello sobat.
Contoh Soal Larutan Penyangga Perbandingan Volume – 20 contoh soal dan pembahasanya hello sobat. Tentukan ph larutan penyangga ka ch 3 cooh 1 8 x 10 5 pembahasan. Jumlah mol ch 3 cooh 50 ml x 0 1 mmol ml 1. Jika ph larutan 5 maka konsentrasi h 1 x 10 5. Fenol c 6 h 5 oh merupakan asam lemah dengan k a 10 10 sebanyak 30 ml larutan fenol 0 1 m dititrasi dengan larutan naoh 0 1 m nilai ph dalam labu titrasi dimonitor dengan ph meter. H ka x mol al mol garam al asam..









